I LEGAMI
Gli atomi che compongono le molecole sono legati da forze chiamate legami, gli elettroni di valenza ( quelli del livello energetico più esterno) sono i responsabili di questi legami chimici. Questo perchè gli elettroni esterni sono quelli con energia di ionizzazione Ei minore e di conseguenza sono i più facili da strappare o mettere in comune.
Esistono due tipi di legami generali:
-i legami intramolecolari: ossia legami interni alla molecola, questo renderebbe la molecola libera di volare via
-i legami intermolecolari: ossia legami con più molecole
Ma perchè si formano questi legami?
Perchè gli atomi tendono spontaneamente a legarsi, inoltre gli atomi spesso hanno energia minore se sono legati con altri atomi, rispetto a quando sono da soli, di conseguenza sono più contenti se sono legati, e come ultima cosa si legano perchè l'attrazione che ha il nucleo verso il suo elettrone, non attrae solo l'elettrone dello stesso atomo ma attrae anche gli elettroni di atomi vicini!
Due atomi si legano ogni qual volta hanno due elettroni in grado di condividere
ognuno dei due atomi deve partecipare alla condivisione
le energie dei due atomi non deve essere troppo diversa ( s o p)
la differenza di elettronegatività non deve essere >2
devono congiungersi in una direzione che gli permette la massima sovrapposizione degli orbitali
 Ma se volessimo rompere questo legame?
Ma se volessimo rompere questo legame?
Per rompere un legame bisogna fornire a esso energia proveniente dall'esterno di diversa intensità( in base al legame è diversa)
la rottura del legame chimico quindi NON è spontanea!
Ma la rottura di un legame chimico produce energia, così come la formazione spontanea. Quindi chiamiamo energia di legame l'energia necessaria per rompere un dato legame, ma anche l'energia che viene prodotta quando questo si crea.
Lewis nel 1916 studiando i gas nobili nota che tutti a parte l' elio hanno il livello esterno pieno a 8 elettroni e capisce che la loro stabilità deriva proprio da questo. Quindi capisce che anche tutti gli altri elementi cercano di raggiungere questa stabilità chiamata ottetto.
Per legarsi gli atomi possono mettere in comune una coppia o più di elettroni.
Chiameremo con un trattino (-) le coppie di elettroni di non legame mentre con un pallino quelli di legame
Ecco alcuni esempi.

Legame di valenza VB
si forma tra due atomi che hanno orbitali spaiato o semi voti al fine di avere la saturazione, si crea quando sono abbastanza vicini.
l'energia potenziale ep è l'energia che diminuisce per la formazione del legame chimico
ci sono forze di repulsione e quelle di attrazione le forze di repulsive tendono a rompere il legame devono esserci forze attrattive che bruscamente fanno diminuire ep
Il legame covalente è la condivisione di due o più elettroni, entrambi gli atomi realizzano l'ottetto
Si forma così un'orbitale molecolare e non più atomico che gira attorno entrambi i nuclei, i nuclei non si respingono perchè gli elettroni attorno respingono la forza di repupulsione
si chiama legame dativo quel legame in cui un atomo mette a disposizione tutti i suoi elettroni e un altro un orbitale vuoto per fare il legame
ci sono due tipi di legame covalente
-puro o omopolare 0<DX<0,4 dove gli elettroni sono condivisi in egual modo dai due atomi
-polare o eteropolare 0,4<DX<1,9 dove uno dei due atomi attrae più a se gli elettroni e sembra che si sta quasi per " staccare" e schiantare contro l'altro. In questo modo la nuvola di elettroni si sposta verso uno dei due atomi si simboleggia l'atomo più attrattivo con dei S-
Legame ionico teoria di Kossel
questo tipo di legame si stabilisce tra due ioni di segno opposto, quando Dx>1,9 e uno dei due atomi attira a se gli elettroni per un istante, anche se subito dopo tornano a essere condivisi. Si forma una quantità di ioni, più ioni sono più si forma il reticolo cristallino cubico dove un atomo è circondato da sei dell'altro.
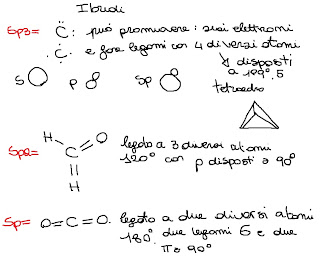
gli orbitali ibridi sono formati da elettroni che vengono promossi a un livello successivo al fine di poter realizzare più legami. I legami sono identici per lunghezza e energia e quindi sono equivalenti
-sp sono disposti a 180°
-sp^2 sono disposti a 120°
-sp^3 sono dsposti a 109° 26' forma tetraedrica
ma come si legano gli elettroni?
-legame di tipo gamma o testa a testa, si uniscono con le teste ed è molto stabile e solido
-legame di tipo pi greco o fianco a fianco, si uniscono con i fianchi ed è meno stabile

Nessun commento:
Posta un commento